Premessa: Una delle esperienze di laboratorio che è molto interessante e coinvolgente, per gli studenti della scuola secondaria di secondo grado, riguarda i “fattori che influenzano la velocità di una reazione chimica”. A tale proposito si prende come esempio la seguente equazione chimica:
Zn + 2HCl → ZnCl2 + H2 ↑
La formazione di gas idrogeno che si verifica mettendo a reagire zinco metallico con acido cloridrico ci permette di avere un’idea sulla velocità di reazione osservando appunto il numero di bollicine di gas che si vengono a formare nell’unità di tempo. E’ chiaro che se lo sviluppo del gas è consistente maggiore sarà la velocità di reazione, viceversa se il gas si forma lentamente con pochissime bollicine, minore sarà la velocità di reazione.
Variando di volta in volta i fattori che possono influenzare tale velocità è possibile individuare, ad esempio, quali siano le condizioni ottimali per far avvenire velocemente la reazione chimica in modo da ottenere in grandi quantità e in breve tempo possibile i prodotti chimici. Generalmente questo è uno studio che viene effettuato anche dalle industrie chimiche prima d’intraprendere la produzione di una qualsiasi sostanza utile per la messa in commercio. Vediamo ora come può essere eseguita questa esperienza in un normale laboratorio scolastico.
FATTORI CHE INFLUENZANO LA VELOCITA’ DI UNA REAZIONE CHIMICA
Obiettivo: Individuare quali fattori influenzano la velocità di reazione.
Materiale:
- Becher da 500ml con portaprovette per bagno maria;
- Provettoni 16x160mm;
- Piastra termica;
- Bilancia tecnica.
Reagenti:
- Zinco metallico in polvere e in pasticche;

- Acido cloridrico 3M;
- Acido cloridrico 0,5M;

- Rame in fili.

Valutazione dei rischi:
Eseguire l’esperienza utilizzando i d.p.i. obbligatori (camice, guanti termici/anti acido e occhialetti para schizzi) ed operare sotto cappa aspirante ovviamente sempre sotto la guida degli insegnanti di chimica.
Procedimento per dimostrare se la concentrazione di un reagente possa influenzare la velocità di reazione:
- In due provette versare 3 pasticche di zinco metallico in ognuna;

- In una delle due provette versare 3ml di HCl 3M e nell’altra 3ml di HCl 0,5M;

- Osservare e confrontare le due provette cercando di scorgere in quale caso si sviluppano più bollicine di gas.

Come si può osservare nella prima provetta, a sinistra dell’immagine, contenente HCl 0,5M, lo sviluppo di particelle di gas è minore rispetto a quelle che si sviluppano nella seconda provetta a destra con HCl 3M. Ciò sta a dimostrare che “maggiore è la concentrazione dell’acido cloridrico e più aumenta la velocità di reazione“.
Procedimento per dimostrare se la temperatura dell’ambiente di reazione possa influenzare la velocità di reazione:
- In due provette versare 3 pasticche di zinco metallico in ognuna;
- Versare 3ml di HCl 0,5M in ognuna e immediatamente porre a bagno maria una delle due provette;
- Osservare e confrontare le due provette cercando di scorgere in quale caso si sviluppano più bollicine di gas.
 Dalla foto è evidente che la provetta immersa nell’acqua bollente all’interno del becher mostra un numero di particelle di gas più elevato rispetto a quella tenuta a temperatura ambiente, per cui possiamo dedurre che ” più è alta la temperatura dell’ambiente di reazione e più è alta la velocità di reazione”.
Dalla foto è evidente che la provetta immersa nell’acqua bollente all’interno del becher mostra un numero di particelle di gas più elevato rispetto a quella tenuta a temperatura ambiente, per cui possiamo dedurre che ” più è alta la temperatura dell’ambiente di reazione e più è alta la velocità di reazione”.
Procedimento per dimostrare se la superficie di contatto dei reagenti possa influenzare la velocità di reazione:
Per avere un’idea di come può variare la superficie di contatto di un reagente, prendiamo ad esempio una torta intera ed una tagliata a fette. Se andassimo a calcolare la superficie esterna di entrambe sicuramente non avremmo dubbi che il valore trovato sarà più alto nel caso della torta tagliata a fette. Risulta evidente che tagliando la torta si scoprirebbero delle zone che prima erano all’interno della torta stessa.
 Per lo stesso motivo possiamo affermare che la superficie di contatto dello zinco in polvere è sicuramente più ampia rispetto a quella dello zinco in pasticche, a parità di peso.
Per lo stesso motivo possiamo affermare che la superficie di contatto dello zinco in polvere è sicuramente più ampia rispetto a quella dello zinco in pasticche, a parità di peso.
Considerando che due reagenti, per trasformarsi in prodotti di reazione, devono necessariamente incontrarsi, urtarsi in modo efficace per rompere i legami chimici così da permettere la formazione di nuovi composti chimici (prodotti di reazione), possiamo sicuramente affermare che aumentando la superficie di contatto dei reagenti aumentiamo la probabilità che tutto ciò possa avvenire. Vediamo come è possibile verificarlo:
- In una provetta mettere 3 pasticche di zinco in pasticche;
- In una seconda provetta mettere lo stesso quantitativo in peso di zinco in polvere;
- Aggiungere in entrambe le provette 3 ml di HCl 0,5M.
Come si può osservare dall’immagine, lo sviluppo di gas idrogeno è maggiore nella provetta in cui vi è zinco in polvere (a sinistra). Possiamo affermare quindi che “maggiore è la superficie di contatto dei reagenti, maggiore è la velocità di reazione“. Procedimento per dimostrare se la presenza di un catalizzatore possa influenzare la velocità di reazione:
Procedimento per dimostrare se la presenza di un catalizzatore possa influenzare la velocità di reazione:
Si usano, in questo caso come catalizzatore, fili di rame sminuzzati.
- In due provette versare 3 pasticche di zinco metallico in ognuna;
- In una delle due provette aggiungere qualche filetto di rame;
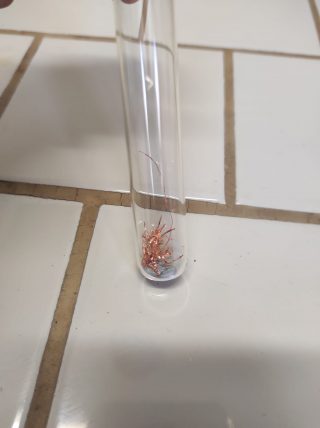
- Versare in entrambe le provette 3ml di HCl 3M e osservare cosa succede.
 E’ possibile vedere che la provetta contenente rame metallico in fili presenta uno sviluppo consistente di bollicine di gas idrogeno per cui possiamo affermare che “la presenza di un opportuno catalizzatore, la velocità di reazione aumenta“
E’ possibile vedere che la provetta contenente rame metallico in fili presenta uno sviluppo consistente di bollicine di gas idrogeno per cui possiamo affermare che “la presenza di un opportuno catalizzatore, la velocità di reazione aumenta“


Inizio dell’anno con un’interessante e bella rappresentazione complimenti Prof.
Grazie per la condivisione del materiale.
Grazie elettrico, era molto tempo che non scrivevo articoli.