Obiettivo
Verificare e riconoscere alcuni elementi, quando questi vengono posti direttamente sulla fiamma di un becco bunsen, in base alla colorazione che la fiamma stessa assume.
Valutazione rischi
L’esperienza prevede l’uso delle fiamme del becco bunsen e l’impiego di acidi ed è quindi necessario usare tutti i dispositivi di protezione individuali come il camice, gli occhialetti di protezione, guanti anti-acido e lavorare usando una cappa aspirante. Attenzione alle possibili piccole ustioni che devono essere immediatamente trattate con acqua corrente per limitare i danni tissutali e ai piccoli tagli che vanno prontamente disinfettati e protetti da cerotto. Ovviamente è indispensabile la presenza dei docenti di laboratorio.
Materiale occorrente per il saggio alla fiamma
Filo di platino o di nichel-cromo,
becco bunsen,
provette, porta provette, vetrino blu al cobalto, piastra di porcellana con pozzetti
o vetrino da orologio, mortaio e pestello,
Spettroscopio (LINK PER L’ACQUISTO)
Reagenti
Acido cloridrico concentrato, cloruri di: sodio, litio, calcio, bario, stronzio, rame, potassio, rubidio, cesio.
Principio del metodo
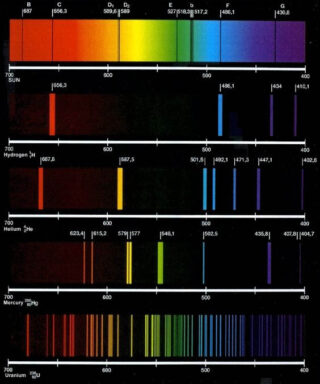
Gli atomi posseggono una particolare struttura elettronica ed è possibile identificarli attraverso lo studio delle frequenze degli spettri di emissione. I saggi alla fiamma, infatti, si basano sulla proprietà che hanno gli atomi di emettere radiazioni luminose quando vengono opportunatamente eccitati da una fonte di energia, in particolare dal calore emesso da una fiamma.
Procedimento
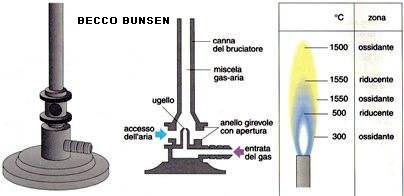
Preparare, sotto cappa, diverse provette contenenti 6-8 ml di acido cloridrico concentrato e predisporre il posto di lavoro con un becco bunsen, filo di platino e piastra con pozzetti contenenti i vari cloruri di metalli diversi da testare. Sempre sotto cappa aspirante con filtri di carbone attivo, accendere il becco bunsen in modo da formare una fiamma ossidante regolando l’entrata dell’aria fino a quando si noterà un cono blu capovolto nella fiamma poco luminosa e molto calda.
La prima operazione da fare è pulire il più possibile il filo di platino o di nichel-cromo in modo che non dia colorazione propria operando come segue:
- Tenere il porta filo, (che può avere la parte terminale a forma di ansa), come una penna ed immergerlo nella provetta con acido cloridrico;
- Portarlo quindi sulla fiamma, tenendolo orizzontalmente e facendo in modo che la punta si vada a situare poco più in alto della punta del cono interno della fiamma stessa, (zona più calda).
 Se il filo non da alcuna colorazione si può procedere con l’esperienza, altrimenti bisogna ripetere l’operazione di pulitura. Usare nuovo HCl quando questo assume una colorazione gialla;
Se il filo non da alcuna colorazione si può procedere con l’esperienza, altrimenti bisogna ripetere l’operazione di pulitura. Usare nuovo HCl quando questo assume una colorazione gialla; - Pulito il filo, immergerlo nuovamente nell’HCl e con la punta del filo, prelevare pochi granellini della sostanza da analizzare posta in uno dei pozzetti della piastra di porcellana; se la sostanza presenta grossi granuli, polverizzarla usando un mortaio e pestello;
- Portare la sostanza nella parte più calda della fiamma e osservare attentamente la tonalità del colore che la fiamma stessa assume, la durata e se scoppiettante, annotando tutte le variazioni possibili. Nel caso del sodio e del potassio verificare i cambiamenti di colore anche attraverso l’uso di un vetrino al cobalto;

- Dopo aver osservato più volte il comportamento della fiamma con il primo elemento, pulire accuratamente il filo sempre con acido cloridrico per poter di nuovo effettuare la prova con un altro elemento. Effettuare la prova con il sodio e il litio per ultimi perché sporcano il filo più degli altri elementi;
- Interessante è osservare le colorazioni della fiamma attraverso uno spettroscopio che permette di vedere direttamente le bande luminose colorate tipiche di ogni campione esaminato.
Finito di annotare tutto quello che si è osservato con l’utilizzo dei vari elementi, sarebbe opportuno provare a riconoscerli utilizzando una polvere costituita da un miscuglio 2 o 3 sostanze incognite facendo attenzione, qualora la fiamma assuma colorazioni non molto evidenti, ad isolare i granellini, presenti nella polvere incognita, con l’estremità del filo e testarli separatamente. Così facendo potrete vedere meglio il comportamento della fiamma e riconoscere gli elementi più facilmente. Qualora sia presente sodio, (in quanto forma una colorazione molto intensa giallo-arancio), usare il vetro al cobalto per verificare la presenza di potassio che potrebbe essere mascherato dal sodio, riconoscibile dalla presenza di un colore violetto chiaro.
Risultati
I colori che la fiamma assumerà per ogni elemento analizzato saranno i seguenti:
ATTENZIONE: l’esperienza va effettuata sotto la guida di un insegnante di chimica prendendo tutte le misure di sicurezza previste dall’attuale normativa. E’ indispensabile usare tutti i dispositivi di protezione individuale quali il camice ignifugo antiacido, mascherine, occhialetti di protezione ecc.. Lavorare in laboratorio con impianto di aerazione forzata, sotto cappa aspirante a carboni attivi.







