La cristallizzazione è stata a lungo utilizzata nella purificazione delle sostanze. Si tratta essenzialmente di una tecnica di separazione solido-liquido molto importante per ricavare un sale puro. Affinché la cristallizzazione abbia luogo una soluzione deve essere “sovrasatura”, ovvero una condizione in cui il liquido (solvente) contiene più solidi disciolti (soluto) della massima quantità che può contenere a quella temperatura. Consideriamo un esempio che è abbastanza facile da immaginare. Prendiamo un pentolino di acqua bollente, versiamo sale da tavola e mescoliamo fino ad ottenere una soluzione acqua-sale. Continuiamo aggiungendo sale fino a che non se ne scioglie più (questa è una soluzione satura). Il sale presente sul fondo, che non si è dissolto, aiuterà ad iniziare la cristallizzazione. Questo primo passo è chiamato “nucleazione” o nucleazione primaria in cui la crescita di un nuovo cristallo comincerà proprio da questo seme e raffreddando gradualmente la soluzione, le dimensioni del cristallo aumenteranno fino a prendere forma ben definita. Il secondo meccanismo principale nella cristallizzazione è chiamato nucleazione secondaria. In questa fase di cristallizzazione, la crescita dei cristalli viene avviata con una bacchettina di vetro, su una parete del becher, ma Il miglior metodo per indurre la cristallizzazione è quello dell’innesco, che consiste nell’introdurre nella soluzione raffreddata uno o due cristalli della sostanza da purificare. Questa fase di cristallizzazione avviene generalmente nella sovrasaturazione inferiore, (fondo del becher), in cui la crescita dei cristalli è ottimale.
Scelta del solvente: Affinché la cristallizzazione possa essere efficace, è necessario scegliere il solvente più appropriato. Un buon solvente di cristallizzazione deve avere le seguenti caratteristiche:
- un potere solvente nei confronti della sostanza da purificare alto a temperatura elevata e basso a temperatura bassa;
- non deve reagire con la sostanza da purificare;
- deve sciogliere facilmente a basse temperature le impurezze oppure non scioglierle affatto;
- deve essere facilmente allontanabile dal prodotto purificato.
Quest’ultima caratteristica implica che il solvente abbia un punto di ebollizione relativamente basso e sia perciò in grado di evaporare facilmente. Nel caso in cui un unico solvente non sia in grado di soddisfare tutti questi requisiti, è possibile utilizzare una miscela di due solventi.
Materiale: Becker, piastra elettrica, cristallizzatore, bacchetta di vetro, spatolina, imbuto di vetro, carta da filtro, sostegno in ferro, filtro buchner, beuta codata, pompa aspirante.
Sali da cristallizzare: sodio cloruro, solfato rameico.
Fasi operative:
- Preparazione di una soluzione sovrasatura: In laboratorio, a causa del poco tempo a disposizione, si può svolgere una semplice cristallizzazione utilizzando come sali da purificare solfato rameico e sodio cloruro. Per ottenere la soluzione sovrasatura, si aggiunge, agitando con una bacchettina di vetro, uno dei due sali in un becher o in un cristallizzatore (LINK PER L’ACQUISTO) contenente acqua distillata. Si riscalda la soluzione con una piastra elettrica e si continua ad aggiungere sale, poco alla volta, fino a che non se ne scioglie più. Per il solfato rameico sciogliere 10g in 20ml di acqua distillata.

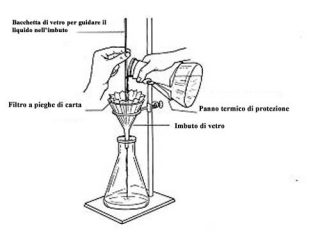
- Filtrazione: Per allontanare le impurezze insolubili è necessario filtrare la soluzione quando è ancora calda. Infatti, se si lascia raffreddare la soluzione, i cristalli che si depositano potrebbero inglobare nella loro struttura delle impurità. Una rapida filtrazione può essere eseguita utilizzando un filtro a pieghe (carta da filtro che, essendo ripiegata “a ventaglio”, presenta un grande sviluppo superficiale), o sfruttando il vuoto per aumentare la velocità dell’operazione. La filtrazione sotto vuoto viene utilizzata generalmente per rimuovere impurezze solubili e solvente dai cristalli della sostanza purificata. Un imbuto di Bùchner o di Hirsch viene strettamente fissato, per mezzo di un tappo di gomma, sul collo di una beuta per filtrazione (detta pure “beuta codata” o “beuta da vuoto”). Un disco di carta da filtro di dimensioni tali da ricoprire tutti i fori dell’imbuto viene posto all’interno dell’imbuto stesso ed inumidito con alcune gocce del solvente utilizzato per la cristallizzazione. La beuta per filtrazione viene poi collegata, per mezzo di un tubo di gomma ad una pompa ad acqua fissata ad un rubinetto. Quindi si applica il vuoto facendo scorrere l’acqua di fonte attraverso la pompa. Una volta che la carta da filtro è perfettamente aderente alla piastra forata dell’imbuto, la soluzione e i cristalli vengono trasferiti nell’imbuto. La soluzione passa attraverso la carta da filtro, mentre i cristalli si depositano sulla carta stessa.

- Raffreddamento e formazione dei cristalli: Dopo aver filtrato rapidamente la soluzione, si lascia raffreddare lentamente in un contenitore di vetro pyrex detto cristallizzatore. Dopo qualche ora si formeranno dei bellissimi cristalli fino a raggiungere dimensioni tali da poter essere visti ad occhio nudo od altrimenti con l’aiuto di uno stereomicroscopio.



Valutazione rischi: è indispensabile usare tutti i Dispositivi di protezione individuali come il camice, gli occhialetti e guanti termici per evitare scottature. La soluzione di solfato rameico (di cui è linkata la scheda di sicurezza), va scaldata in ambiente aerato, maneggiata con attenzione e in presenza dei docenti di laboratorio.
Un semplice video, di seguito linkato su Youtube, ci aiuterà a capire le varie fasi operative per ottenere, in un laboratorio scolastico, dei bellissimi cristalli.
🙄 CLICCA QUI’ SOPRA PER VEDERE IL VIDEO 🙄


Grazie mille è stato molto utile per arrichire la mia relazione
Grazie!!!!!!! Davvero utili
Bel lavoro, complimenti ai ragazzi. Queste “esperienze di laboratorio” si tradurranno in “esperienze utili” nel mondo del lavoro, e nella professione. Continuate
così, non sottovalutate l’importanza dei “laboratori nelle scuole”.
Grazie per la collaborazione dei ragazzi nella realizzazione del video anche se, per motivi di privacy, non ho potuto indicare i nominativi.