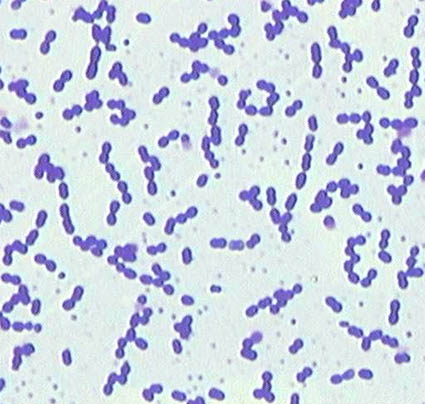
Gli Enterococchi sono un gruppo di microrganismi Gram positivi, catalasi negativi, dalla forma rotondeggiante od ovaliforme, spesso disposti in catenelle. Sono microorganismi generalmente immobili, aerobi/anaerobi facoltativi aventi un metabolismo fermentativo di tipo lattico. Questi cocchi, pur resistendo eccellentemente alle condizioni ambientali esterne, non sono sporigeni. Solo di rado, gli enterococchi sono beta-emolitici; infatti, spesso non generano alcuna emolisi in terreno agar sangue. Occasionalmente, questi enterococchi commensali possono creare danno, fino a causare endocarditi, mastoiditi, ascessi ed infezioni a carico delle vie urinarie. Gli enterococchi sono largamente diffusi in natura e si ritrovano spesso nel materiale fecale di animali vertebrati (compreso l’uomo). Il significato della presenza degli enterococchi in un corpo idrico è ancora dibattuto, ma riscontrandoli generalmente con i Coliformi fecali rinforza l’ipotesi di inquinamento fecale di un corpo idrico. Per molto tempo, gli enterococchi sono stati etichettati come microrganismi streptococcici appartenenti, per le loro peculiari caratteristiche antigeniche, al gruppo D di Lancefield. Il genere Enterococcus è stato però, negli anni ottanta, distinto dal genere Streptococcus grazie ai recenti studi sulle caratteristiche fisiologiche e di tecniche di ibridizzazione del DNA. Attualmente le specie appartenenti al genere Enterococcus, che vengono definite in grado di ridurre il 2,3,5-trifeniltetrazolio cloruro a formazano e di idrolizzare l’esculina a 44 °C, soddisfano specifici requisiti: crescita a 10°C e 45°C, resistenza a 60°C per 30 minuti, tollerano i sali biliari al 40%, crescita a pH 9,6 e al 6,5% di NaCl, idrolisi del 4-metilumbelliferil-β-D-glucoside (MUD) in presenza di tallio acetato, acido nalidixico e 2,3,5- trifeniltetrazolio cloruro (TTC).
I gruppi individuati in questo genere comprendono Ent. faecium, Ent. durans, Ent. hirae, Ent. mundtii (primo gruppo); Ent. avium, Ent. pseudoavium, Ent. raffinosus e Ent. malodoratus (secondo gruppo); Ent. casseliflavus e Ent. gallinarum (terzo gruppo); Ent. faecalis, Ent. cecorum, Ent. colombae e Ent. saccharolyticus, che hanno tra loro una bassa similarità genotipica, sono stati inseriti in un quarto gruppo.
La presenza di enterococchi nelle acque destinate al consumo umano è segnalata raramente. Evenienze di questo tipo sono comunque da mettere in relazione a sicura contaminazione di origine fecale, spesso dovuta ad infiltrazioni dall’esterno. Inoltre, gli enterococchi nelle acque in distribuzione sono un segnale della ridotta efficienza del sistema di trattamento delle acque.
Negli ultimi anni sono stati formulati metodi rapidi per la ricerca dei microrganismi appartenenti al genere Enterococcus basati su attività enzimatiche specifiche e che non necessitano dello svolgimento di prove di conferma. I metodi più classici sono comunque da ritenersi ancora validi anche se tuttora comportano lo svolgimento di prove aggiuntive per l’accertamento dell’appartenenza al genere. Nelle acque destinate al consumo umano è prescritta l’assenza obbligatoria degli enterococchi in relazione al loro ruolo di indicatori di contaminazione fecale. Il superamento del valore parametrico (Enterococchi 0 in 100 o 250 ml) costituisce una non conformità al valore stabilito dal DL.vo n. 31 del 2001 (Allegato I, parte A) e s.m.i..
Libro consigliato: Link Microbiologia delle acque destinate al consumo umano
Principio del metodo: La procedura analitica si basa sul conteggio dei microrganismi presenti in un volume noto del campione di acqua. Possono essere utilizzate le seguenti tecniche analitiche:
– Metodo A: metodo del numero più probabile o dei tubi multipli (MPN). Con questo metodo, che consiste in una prova presuntiva e in una prova di conferma, è calcolata la densità degli streptococchi/enterococchi in campioni di acqua tramite una stima statistica determinata sulla base della combinazione di tubi positivi e negativi ottenuti inoculando aliquote diverse del campione in terreno colturale liquido. Il risultato può essere ricavato, in base alle diverse combinazioni, da un’apposita tabella già predisposta.
– Metodo B: metodo del numero più probabile (Most Probable Number, MPN) in micropiastre a 96 pozzetti, basato sul rilevamento dell’attività enzimatica della ß-glucosidasi, evidenziabile dall’idrolisi di un ß-glucoside, con rilascio di composti colorati e fluorescenti. Il campione diluito è inoculato in 96 pozzetti da 350 μl contenenti il terreno di coltura disidratato. Dopo un periodo di incubazione di 36-72 ore a 44±1°C si procede alla lettura dei risultati sotto lampada di Wood (366 nm). L’idrolisi del 4-metilumbelliferil-β-D-glucoside (MUD) produce fluorescenza blu nei pozzetti.
– Metodo C: metodo della filtrazione su membrana (MF). Questo metodo permette di contare il numero delle colonie cresciute su una membrana posta su terreno colturale agarizzato. Esistono in commercio diversi substrati usati per l’isolamento degli enterococchi che garantiscono buoni risultati in fase analitica, anche se non esiste un unico substrato in grado di far crescere tutte le specie presenti. È necessario in ogni caso tenere in considerazione che la scelta di un substrato o dell’altro può essere effettuata sulla base dell’esperienza dell’operatore a condizione che ciò non comporti alcun cambiamento delle caratteristiche di produttività.
Campo di applicazione: La procedura analitica è utilizzata per acque superficiali, di fiume, di lago e per acque reflue anche sottoposte a trattamento. In questo articolo seguiremo il metodo della filtrazione su membrana (MF).
METODO C. Metodo della filtrazione su membrana (MF)
Il metodo è indicato dal Dlgs 02/02/2001, n 31 quale riferimento analitico per valutare la contaminazione fecale delle acque destinate al consumo umano, nella determinazione degli Enterococchi intestinali. In questo modo sarà possibile l’isolamento di Enterococcus faecium, E. durans, E. hirae e del genere Streptococus. Si potrà determinare la concentrazione di enterococchi che, presenti in un campione di acqua, sulla superficie di una membrana, posta su terreno di coltura agarizzato, hanno formato colonie tipiche prodotte dai microrganismi ricercati. Il metodo riportato corrisponde alla norma ISO 7899-2:2000.
Interferenze e cause d’errore: L’acqua non deve presentare torbidità e particelle sedimentabili. Il terreno di coltura è a bassa selettività, per cui uno sviluppo microbico di base potrebbe interferire nel rilevamento e numerazione dei gruppi batterici interessati. Pertanto questo metodo è indicato per acque chiare disinfettate o con basso concentrazione di batteri.
Conservazione dei campioni: Il campione deve essere analizzato preferibilmente subito dopo il campionamento e non oltre 24 ore conservandolo a 5°C ± 3°C.
APPARECCHIATURE E STRUMENTI
- pHmetro;
- conduttimetro;
- kit per la rilevazione di Cl2 libero;
- apparecchiatura per filtrazione con membrane filtranti sterili, di porosità 0.45 μm;
- pinze in acciaio con punta piatta, vetreria di laboratorio, pipette monouso sterili da 10 ml;
- incubatore termostatico regolato a 36°C ± 2;
- incubatore termostatico regolato a 44°C ± 0,5;
- bagno maria, becco bunsen, vetreria dedicata alla preparazione dei terreni, diluenti, reagenti, autoclave;
- filtri sterili per siringa porosità 0.45 μm.
TERRENI DI COLTURA E REAGENTI
- Agar sodio azide (Slanetz & Bartley) la cui composizione base è:
Triptosio 20 g
Estratto di lievito 5 g
Destrosio 2 g
Dipotassio idrogeno fosfato 4 g
Sodio azide 0,4 g
Agar 10 g
Acqua distillata 1000 mL
pH 7,0±0,2
Preparata la soluzione, proteggere dalla luce e scartare se assume una colorazione rosata. Il terreno completo, contenente TTC, si trova anche in commercio in forma disidratata e si prepara secondo le istruzioni della ditta produttrice. Nel caso debba essere preparato dai singoli ingredienti, aggiungere, a 1000 ml di terreno base, mantenuto a una temperatura di 50-60°C, 10 ml di una soluzione all’1% di 2,3,5-Trifenil-tetrazolio cloruro sterilizzata mediante filtrazione con filtri da 0,2 μm. Qualora sia necessario correggere il pH, utilizzare una soluzione di sodio carbonato (100 g/l). Adottare idonee precauzioni durante la preparazione del terreno che è tossico e mutageno per la presenza di azide sodica. Evitare il contatto e l’inalazione. Non sterilizzare. Dopo la preparazione del terreno distribuire in capsule di Petri e conservare a circa +4°C per non più di 2 settimane in condizioni ottimali; - Terreno all’Esculina-bile-azide Agar la cui composizione è:
Triptone 17 g
Peptone 3 g
Estratto di lievito 5 g
Bile 10 g
Esculina 1,0 g
Ferro (III) ammonio citrato 0,5 g
Sodio cloruro 5 g
Sodio azide 0,15 g
Agar 15 g
Acqua distillata 1000 mL
pH 7,1±0,1
Adottare idonee precauzioni durante la preparazione del terreno che è tossico e mutageno per la presenza di azide sodica. Evitare il contatto e l’inalazione. Dopo avere sciolto la polvere, sterilizzare a 121±3°C per 15±1 minuti. Distribuire in capsule Petri e lasciare solidificare. Conservare a circa +4°C per non più di 2 settimane in condizioni ottimali; - Agar Soia Triptone la cui composizione è:
Triptone 15 g
Peptone di soia 5 g
Sodio cloruro 5 g
Agar 20 g
Acqua distillata 1000 ml
pH 7,2±0,2
Il terreno si trova anche in commercio in forma disidratata e si prepara secondo le istruzioni della ditta produttrice. Dopo avere sciolto la polvere, sterilizzare a 121±3°C per 15±1 minuti. Distribuire in capsule Petri e lasciare solidificare. Conservare a circa +4°C per non più di 2 settimane in condizioni ottimali; - Perossido di idrogeno al 3% (reattivo per la prova della catalasi). La soluzione è disponibile in commercio pronta all’uso alla concentrazione indicata. Conservare al riparo dalla luce diretta e ad una temperatura di circa +4°C fino alla data di scadenza.
- Kit per la colorazione del Gram;
PROCEDIMENTO
Preparazione del campione: Per l’analisi è necessario determinare il volume in base alla tipologia e alla qualità dell’acqua da esaminare. Per acque reflue o comunque di bassa qualità generalmente è necessario analizzare diluizioni scalari del campione; mentre per acque già sottoposte a trattamento possono essere analizzate diluizioni minori e comunque aliquote diverse. Si raccomanda di operare in asepsi. Si ricorda inoltre l’importanza di ricevere un campione per l’analisi opportunamente campionato e conservato, sufficientemente rappresentativo, al fine di ottenere dati analitici corretti e riproducibili. Per questo il campione di acqua deve essere prelevato da personale esperto che segua una corretta procedura per la manipolazione e movimentazione del campione. Se il laboratorio riterrà idoneo il campionamento, procederà con l’analisi; altresì sarà richiesto un ulteriore aliquota.
Preparazione dell’inoculo ed esame delle piastre:
- Agitare il campione ripetutamente.
- Filtrare, rispettando le condizioni di asepsi, un’aliquota del campione (per le acque di pozzo generalmente 100 ml) o un volume di una sua diluizione, attraverso una membrana di esteri di cellulosa con pori di 0,45 μm di diametro.


- Porre la membrana, con la pinzetta, sulla superficie del substrato di isolamento (Agar sodio azide) in una piastra.
- Incubare a 36±1°C per 44±4 ore.
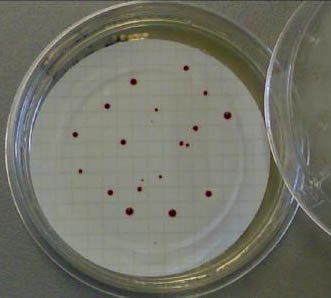
- Esaminare le colonie sospette caratteristiche: gli enterococchi si presentano in colonie tonde, piccole ( 1-2 mm) di colore rosso, rosa o rosso mattone.
- Trasferire la membrana su cui si sono sviluppate le colonie sospette, sul terreno all’esculina, pre incubato a 44°C.
- Incubare a 44°C per 2 ore.
- Leggere la piastra dopo il tempo indicato; si considerano enterococchi intestinali quelli che hanno formato sul terreno differenziale all’esculina un alone nero-marrone che compare sul retro della membrana, in corrispondenza delle colonie.
- Per la prova della catalasi scegliere le colonie isolate da una sottocoltura in TSA; prelevare con l’ansa di platino un frammento della colonia e deporla su un vetrino ben pulito, aggiungere qualche goccia di acqua ossigenata al 3%. La presenza di effervescenza indica presenza di catalasi.
- Per l’esame morfologico scegliere le colonie isolate da una sottocoltura in TSA.
- Eventualmente effettuare l’identificazione delle colonie sospette utilizzando i sistemi miniaturizzati di identificazione biochimica sulla base delle indicazioni della ditta produttrice.
ESPRESSIONE DEI RISULTATI
Il numero di microrganismi si calcola in base al numero di colonie tipiche contate ed eventualmente sottoposte a conferma, riportando il valore come Unità Formanti Colonia per 100 ml di campione (UFC/100 mL). Dal numero di colonie caratteristiche contate, calcolare il numero di microrganismi presenti in 100 ml del campione in base alla seguente formula:
\( C=frac{Acdot Ncdot Vscdot F}{Bcdot Vt} \)
dove:
C = numero di colonie che sono state confermate per 100 mL;
A = numero di colonie confermate;
B = numero di colonie da sottoporre a conferma;
N = numero di colonie caratteristiche contate sulla membrana;
Vt = volume (ml) di campione analizzato;
Vs = volume di riferimento per l’espressione dei risultati (100 ml);
F = fattore di diluizione.
RIFERIMENTI BIBLIOGRAFICI
ISO 7899-2 :2000(E)
Dlgs 02/02/2001, n 31
APAT IRSA CNR man 29, sez. 7000, 2003
ISO 6887-1:1999 (E)
ISO 7218:2007
ISO 8199: 2005 (E)
UNI ENV ISO 11133-1 2002



Complimenti!!! Davvero un ottimo lavoro!
Grazie dei complimenti e per aver seguito i nostri articoli.