In diverse reazioni chimiche è possibile notare delle doppie frecce, ( ⇋ ), poste tra i reagenti e i prodotti di reazione. Ciò sta ad indicare che vi è un equilibrio dinamico tra le sostanze che reagiscono e quelle che si formano e, a seconda della natura dei reagenti questi possono trasformarsi in prodotti e viceversa, in base alla loro costante di equilibrio Keq.
Una volta raggiunto l’equilibrio chimico, esiste un rapporto tra le concentrazioni dei reagenti e quelle dei prodotti. Questo rapporto è espresso tramite la costante di equilibrio, nel caso in cui si abbia una reazione reversibile. La costante d’equilibrio è il rapporto tra le concentrazioni dei prodotti e le concentrazioni dei reagenti, ciascuno elevato al proprio coefficiente stechiometrico, moltiplicate tra di loro.
Data la reazione aA+bB ⇋ cC+dD, indicando con a, b, c e d i coefficienti stechiometrici, mentre con A, B, C e D le concentrazione rispettivamente di reagenti e prodotti, la costante di equilibrio è:
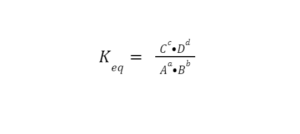
Una reazione si definisce all’equilibrio (o più precisamente all’equilibrio dinamico) quando la formazione di prodotti e di reagenti avviene con la stessa velocità. Quando questo scambio, reagenti ⇋ prodotti, avviene alla stessa velocità, allora la reazione ha raggiunto l’equilibrio. Macroscopicamente, quindi, non si avrà nessun cambiamento, le concentrazioni permangono le stesse, ma microscopicamente le due reazioni continuano ad avvenire sia in un senso che nell’altro.
Secondo il principio di Le Châtelier, un sistema all’equilibrio reagisce ad una qualsiasi perturbazione, tendendo a tornare in equilibrio, opponendosi alla perturbazione. Con perturbazione si intendono modificazioni del sistema, come un cambiamento della concentrazione dei reagenti o dei prodotti, di volume o pressione, ma anche di temperatura. Per esempio, se ad una reazione all’equilibrio si aggiungono di colpo dei reagenti, il sistema risponderà con un aumento della concentrazione dei prodotti e viceversa.
Il valore numerico della costante di equilibrio è caratteristico per ciascuna reazione chimica e dipende unicamente dalla temperatura. Può essere un qualsiasi numero maggiore di zero. Nel caso in cui il valore di Keq è alto, significa che il numeratore è maggiore rispetto al denominatore. Ciò si verifica quando la concentrazione dei prodotti è superiore a quella dei reagenti e quindi, il sistema è spostato verso la formazione dei prodotti, altrimenti se è un numero piccolo (molto inferiore a 1), la concentrazione dei reagenti è superiore a quella dei prodotti.
In questa esperienza vedremo come interagiscono i reagenti e i prodotti di una reazione chimica variando le loro concentrazioni.
Per osservare meglio ciò che avviene in questi casi, verranno utilizzati dei reagenti e dei prodotti che presentano diverse colorazioni che cambiano di tonalità in funzione della loro concentazione. La reazione chimica è la seguente:
FeCl3 + 3 KSCN ⇋ Fe(SCN)3 + 3 KCl
Allestendo due provette contenenti una KCNS 0,01M e l’altra FeCl3 0,01M e dopo aver unito questi due reagenti nella terza provetta, si otterrà una soluzione contenente un prodotto, Fe(SCN)3 colorato in rosso acceso. Allo stesso modo, preparando i due reagenti alla concentrazione di 0,005M, si otterrà, dopo averli mescolati nell’ultima provetta, una soluzione con minore concentrazione dello stesso prodotto, ma con una colorazione rosata.

Titolo dell’esperienza:
EQUILIBRIO CHIMICO
Obiettivo:
Osservare il cambiamento della colorazione delle soluzioni dei reagenti e dei prodotti quando si variano le loro concentrazioni. La reazione chimica presa in considerazione è la seguente:
FeCl3 + 3 KSCN ⇋ Fe(SCN)3 + 3 KCl
ELENCO DEL MATERIALE:
- 2 Beute da 100 ml;
- 2 vetrini da orologio;
- Provette 16X160mm;
- 3 pipette graduate da 5 ml;
- 2 spatole.
ELENCO SOSTANZE:
- Cloruro ferrico FeCl3 0,01 M (Nocivo e corrosivo, scheda di sicurezza al link);
- Tiocianato di potassio KSCN 0,01 M (Nocivo, scheda di sicurezza al link);
- NaOH 0,01M
VALUTAZIONE DEI RISCHI:
Evitare il contatto con i reagenti utilizzando dei guanti in lattice, occhialetti di protezione e camice da laboratorio. Lavorare sotto la guida dei docenti.
PROCEDIMENTO:
- Preparare 20 ml delle soluzioni di FeCl3 0,01 M e di KSCN 0,01M di e versarle in 2 beute da 100ml;

Soluzioni di cloruro ferrico e poassio tiocianato - Versare, con una pipetta graduata, 5 ml di FeCl3 0,01M in una provetta 16×160;
- Nella stessa provetta versare, con una pipetta graduata, 5 ml di KSCN 0,01M;
- Da quest’ultima ripartire la soluzione ottenuta in 3 provette con 3 ml in ognuna, utilizzando una pipetta graduata da 5ml;
- Siglare la prima provetta con K (controllo di riferimento), la seconda con (+ KSCN) e la terza con (+ FeCl3);
- Aggiungere nella seconda provetta una punta di spatola di KSCN in polvere;

Polvere di KCNS - Aggiungere nella terza provetta una punta di spatola di FeCl3 in polvere;

Polvere di cloruro ferrico - Annotare le varie colorazioni delle soluzioni presenti nelle rispettive provette confrontandole con la soluzione di controllo presente nella prima provetta.

OSSERVAZIONI:
Come si può notare nell’ultima foto, le colorazioni delle soluzioni a cui sono stati aggiunti i rispettivi reagenti hanno cambiato la tonalità, diventando di un rosso più intenso rispetto a quello presente nella prima provetta di riferimento, proprio perchè l’aumento della concentrazione dei reagenti ha determinato un spostamento dell’equilibrio chimico verso la formazione di più prodotto.

