Iniziando dall’esperienza del riscaldamento (fusione) e raffreddamento (solidificazione) dell’acido stearico, immergiamoci a testa bassa nella parte più teorica dei passaggi di stato.
Ogni passaggio da uno stato di aggregazione ad un altro ed ogni transizione da una fase ad un’altra implica una scambio di energia da parte del sistema con l’ambiente.
Quando l’energia passa dall’ambiente al sistema, vuol dire che il sistema riceve calore e la sua temperatura aumenta. In tali condizioni fisiche si hanno i passaggi di stato elencati nel grafico sottostante.
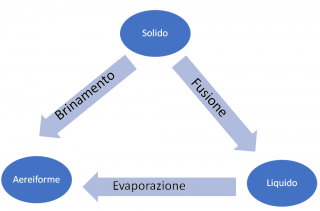
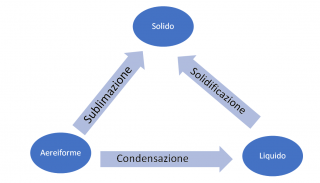
Quando è il sistema a cedere energia, esso perde calore e si misura un abbassamento delle temperature. Qual’ora ci fossero queste condizioni fisiche, le frecce del diagramma soprastante vengono capovolte e sarà l’ambiente ad avere un aumento di energia e di temperatura. I passaggi di stato che avvengono in tali condizioni vengono descritti dal grafico sottostante.
A temperatura sufficientemente bassa (qualche grado kelvin) tutta la materia dell’Universo è allo stato solido. Questo perché esiste una relazione tra temperatura, moto degli atomi e il rispettivo stato di aggregazione.
Anche se gli oggetti macroscopici che osserviamo quotidianamente ci appaiano immobili e statici, non si può dire altrettanto degli atomi. Essi, infatti, sono in continuo moto; vibrando e ruotando intorno ad una posizione media e allungandosi e ritraendosi di continuo. Questo loro eterno moto è indice che il corpo, nella sua complessità, ha un’energia specifica e quindi un valore preciso di temperatura.
Con l’aumentare della temperatura aumenta l’energia e la capacità motoria e vibrazionale degli atomi. I legami chimici (iterazioni elettrostatiche) si indeboliscono, facendo si che il solido si dilati fino al massimo, ovvero fino al raggiungimento dello stato liquido. Continuando ad aumentare l’energia degli atomi essi rompono totalmente i legami per raggiungere la massima dilatazione possibile, che è rappresentata dallo stato aeriforme.
Sottraendo calore, e quindi provocando un abbassamento della temperatura del sistema, il processo che ne consegue è l’opposto a quello sopra descritto, ovvero, un processo di compressione volumetrica della materia, dallo stato aeriforme (volume massimo) a quello del solido (volume minimo).
La relazione tra temperatura ed energia degli atomi, è stata individuata dagli scienziati Maxwell e Boltzmann. Questa relazione, è una relazione statistica che afferma l’esistenza di M particelle, della sostanza, che hanno energia superiore ad un limite E (scelto a piacere) alla temperatura assoluta T
M=N*e-E/RT
Con R, costante universale dei gas.
Da questa legge statistica, che mostra la relazione tra temperatura assoluta ed energia, si evince che soltanto le particelle (atomi o molecole) con sufficiente energia possono mutare il loro stato di aggregazione, mentre le altre particelle devono arrivare ad un altro livello di energia. Questo spiega, se pur brevemente, a cosa serve la sosta termica.
La spiegazione dei passaggi di stato continua, nel prossimo articolo.
Buona permanenza sul sito.


Complimenti per l’articolo, semplice e interessante soprattutto nella correlazione tra il moto degli atomi e la temperatura. Grazie Akira
Chiara e sintetica esposizione sui passaggi di stato. Complimenti.