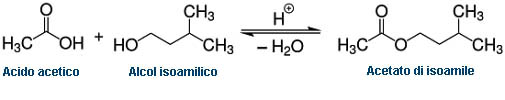
In questa esperienza si prenderanno in esame due composti, l’acido acetico e l’alcol isoamilico, che nella reazione di esterificazione, ovvero una reazione di condensazione tra un alcol e un acido, formeranno un prodotto (estere), l’acetato di isoamile (etanoato di 3-metil-1-butile), caratterizzato da un buon odore di banana.
Cenni teorici:
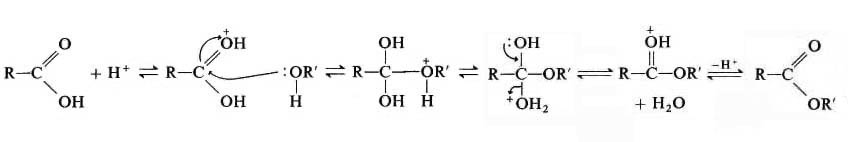
La reazione di esterificazione avviene tra un alcool e un acido carbossilico in ambiente acido con il seguente meccanismo di reazione: Lo ione H+ , fornito per aggiunta di acido solforico, protona l’ossigeno del gruppo carbossilico dell’acido, creando una carica positiva, che permette di combinarsi con il doppietto elettronico dell’ossigeno del gruppo alcolico. Con la successiva eliminazione di una molecola di acqua e di uno ione H+ , si formerà l’estere corrispondente.
Titolo dell’esperienza:
Esterificazione di un acido carbossilico e un alcol
Oggetto:
Preparazione dell’acetato di isoamile, dal caratteristico odore di banana, per reazione di esterificazione con acido acetico e alcol isoamilico.
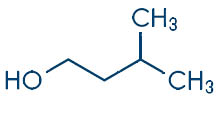
L’acido usato nella prova di laboratorio è l’acido acetico e l’alcol è il 3-metil-1-butanolo (alcol isoamilico). Cliccando sul composto sottolineato vi è il link della scheda di sicurezza.
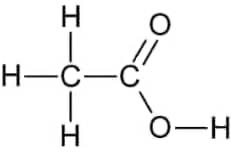
L’estere che si forma è l’acetato di isoamile (etanoato di 3-metil-1-butile):
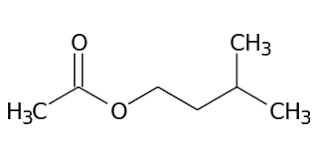
La reazione chimica di formazione dell’Acetato di isoamile è la seguente:
Materiale utilizzato:
- Colonna refrigerante a bolle, (condensatore di Allhin); Link per acquisto
- Beuta o pallone con collo smerigliato da 250 ml;
- Sostegno metallico;
- Mantello riscaldante o in alternativa una piastra riscaldante tenuta a bassa potenza;
- Bilancia tecnica sensibilità: 0,01g;
- Una pipetta graduata da 5 ml con propipetta;
- Imbuto separatore;
- Beuta da 250ml;
- Becher da 100 ml.
Reagenti:
- Acido acetico glaciale 99,5% d.: 1050g/l;
- Alcol isoamilico al 98% con d.: 0,8 g/cm3;
- Acido solforico concentrato 96%;

- NaHCO3 al 5%;
- Na2SO4 anidro;
- Acqua distillata;
- Cartina indicatore di pH
Valutazione dei rischi:
Lavorare utilizzando i dispositivi di protezione individuali come il camice, occhiali para schizzi, mascherina e guanti anti acido e termici. Utilizzare sempre una cappa aspirante e procedere all’esperienza in presenza di personale docente qualificato. Attenzione nell’uso dell’acido solforico concentrato perché molto corrosivo.
Procedimento:
- Lavorando sotto cappa aspirante pesare, direttamente nella beuta con collo smerigliato da 250 ml, 20g di acido acetico glaciale. In alternativa si possono versare 20ml di acido acetico al 99,5%;
- Pesare, in un becher da 100ml, 22,50g di alcol isoamilico al 98%, (0,25 moli), oppure 28,00ml di alcol isoamilico al 98% e versarlo lentamente nella beuta contenente l’acido acetico glaciale;
- Aggiungere molto lentamente 1 ml di acido solforico concentrato al 96% nella beuta;
- Montare sulla beuta con collo smerigliato una colonna refrigerante a bolle (condensatore di Allihn) e posizionare il tutto su di un sostegno metallico vicino ad un rubinetto di lavandino e sotto cappa aspirante;

- Collegare il condensatore di Allhin ad un rubinetto e a uno scarico per permettere l’afflusso di acqua per refrigerare la colonna;
- Posizionare la beuta con il condensatore di Allhin su di una piastra termica (impostare la posizione 2 di bassa potenza per evitare la carbonizzazione dei reagenti) e riscaldare lentamente il miscuglio liquido fino all’ebollzione e lasciare bollire per un’ora circa.
- Trascorsa l’ora spegnere la piastra termica e lasciare raffreddare il liquido fino a temperatura ambiente;
- Travasare il liquido in un imbuto separatore da 250 ml e aggiungere 50ml di acqua distillata fredda, chiudere con il tappo e agitare vigorosamente tenendo premuto il tappo;

- Inserire l’imbuto separatore sul sostegno con anello e attendere finché non si nota la separazione delle 2 fasi;

- Separare le due componenti liquide sapendo che l’acetato di isoamile non è solubile in acqua ed avendo una densità minore di quest’ultima si troverà nella parte superiore;
- Raccogliere quindi la parte acquosa e in quella rimasta nell’imbuto separatore, ovvero di acetato di isoamile, aggiungere 25ml di NaHCO3 al 5% ed agitare fino a quando non smette la formazione di bollicine di anidride carbonica. Fare subito sfiatare il gas liberato. Con questa operazione si elimina, per estrazione l’acetato di sodio formatosi che è solubile nella fase acquosa, togliendo quindi l’odore di aceto, esaltando così quello di banana tipico dell’acetato di isoamile. La reazione chimica è la seguente:
CH3COOH + NaHCO3 → CH3COONa + CO2 ↑ + H2O
- Separare la fase acquosa e misurare il pH di quest’ultima con una cartina indicatore;
- Ripetere l’operazione con altri 25ml di NaHCO3 al 5% fino a che non si ottenga pH=7;
- Eliminare la parte acquosa ormai neutra e raccoglire l’estere in una beuta;
- Nella beuta con l’estere versare circa 1g di Na2SO4 anidro per eliminare residui d’acqua;
- Agitare, coprire e lasciare a riposo per 15-20 minuti; filtrare in un recipiente asciutto.
Calcoli:
- Per determinare i grammi da pesare di acido acetico glaciale al 99,5%, con MM= 60.05, e densità di 1050 g/l si impostano le seguenti proporzioni:
Se in 100g di soluzione vi sono 99,5g di acido acetico le moli corrispondenti sono: n. moli = g/MM = 99,5g/60,05 = 1,657 moli di ac. acetico in 100g di soluzione;
1,657 moli di ac. acetico : 100g di sol. : 1 mole : Xg Xg = 60,35g di soluz. in cui vi è 1 mole di ac. acetico;
in 15,09g di soluzione di acido acetico al 99,5% vi sono 0,25 moli di acido acetico (60,35g/4).
Volendo trovare quanti ml di soluzione di acido acetico al 99,5% contengano 0,25 moli di acido acetico si avrà che:
essendo d=M/V ovvero V=M/d, e considerando i calcoli precedentemente svolti avremo che 0,25 moli di acido acetico sono presenti in 60,35g/4= 15,09g di soluzione. Sostituendo a V=M/d si avrà V= 15,09g/1050g/l = 14,37ml di soluzione di acido acetico al 99,5% in cui sono contenuti 0,25 moli di acido acetico.
Essendo la reazione chimica in equilibrio, per spostarla verso destra si userà un’eccesso di acido acetico glaciale e quindi, come indicato nel procedimento, 15g di acido acetico glaciale o 15ml dello stesso.
- Per determinare i grammi da pesare di alcol isoamilico al 98% con d.: 0,8g/cm3 e MM= 88,15 si esegue il medesimo calcolo:
In 100g di soluzione vi sono 98g di alcol isoamilico e le corrispettive moli sono: n. moli = g/MM = 98g / 88,15 = 1,1117 moli di alcol isoamilico in 100g di soluzione.
1,1117 moli : 100g di sol = 0,25 mole : Xg di soluz. Xg = 22,49g di soluz. in cui vi sono 0,25 moli di alcol isoamilico
Volendo trovare quanti ml di soluzione di alcol isoamilico al 98% contengano 0,25 moli di acido acetico si avrà che:
essendo d=M/V ovvero V=M/d, considerando i calcoli precedentemente svolti avremo che 0,25 moli di alcol isoamilico sono presenti in 88,15g/4= 22,04g di soluzione. Sostituendo a V=M/d si avrà V= 22,04g/800g/l = 27,55ml di soluzione di alcol isoamilico al 98% in cui sono contenuti 0,25 moli di alcol isoamilico.
Nel procedimento è arrotondato a 28,00ml per praticità.
Osservazioni:
In questa esperienza si effettua una sintesi chimica mediante una reazione di esterificazione, con catalisi acida, (esterificazione di Fischer). L’acetato di isoamile o di isopentile (IUPAC: etanoato di 3-metil-1-butile) viene preparato per esterificazione diretta dell’acido acetico con alcool isoamilico o isopentilico (IUPAC: 3-metil-1-butanolo), in ambiente acido e a caldo.
La reazione è di equilibrio e per favorire la formazione dell’estere si può aggiungere un eccesso di uno dei reattivi. L’equilibrio è spostato verso destra (in favore del prodotto) usando, ad esempio, un eccesso di acido acetico, sia perché è il reattivo meno costoso sia perché è più facilmente separabile dalla miscela di reazione. Infatti, durante il trattamento di separazione, una parte dell’eccesso di acido acetico, nonché l’alcool isopentilico non reagito, vengono allontanati con l’impiego dell’imbuto separatore, mentre il rimanente acido acetico, presente nella fase organica, viene eliminato utilizzando una soluzione acquosa di bicarbonato sodico.
L’acetato di isoamile viene utilizzato per aromatizzare gli alimenti ed è prodotto naturalmente dalla pianta di banane o per via sintetica. Viene inoltre rilasciato dai pungiglioni delle api come feromone per attirare altre api.
– Foto e video a cura dell’Ass. tecnico Alfinito Celeste

