Esistono diversi modi per verificare la presenza di gruppi aldeidici in un campione da analizzare e uno di questi è proprio il saggio di Tollens. Il reattivo è costituito da una soluzione di ione diamminoargento, [Ag(NH3)2]+, che in presenza di aldeidi si riduce ad argento metallico. La formazione di quest’ultimo composto ci permette di verificare l’avvenuta reazione chimica in maniera molto evidente. Infatti, sulle pareti interne della provetta di vetro in cui avviene il test si depositano, nel caso siano presenti le aldeidi, le particelle di argento metallico (Ag), formando uno superficie riflettente simile ad uno specchio.
Il reattivo può essere preparato al momento dell’uso facendo reagire il nitrato di argento AgNO3 con idrossido di sodio NaOH con formazione di ossido di argento secondo la reazione:
2 AgNO3 + 2 NaOH → 2 NaNO3 + Ag2O + H2O
L’ossido di argento viene solubilizzato con aggiunta di idrossido di ammonio NH4OH in eccesso, (NH3 in soluzione acquosa), con formazione dello ione diamminoargento [Ag(NH3)2]+ seguendo la reazione:
Ag2O + 4 NH3 + H2O → 2 [Ag(NH3)2]+ + 2 OH–
Le aldeidi riducono lo ione diamminoargento ad argento metallico e, in ambiente basico della soluzione, le aldeidi si ossidano ad acido carbossilico corrispondente.
La semireazione di riduzione dello ione diamminoargento è la seguente:
[Ag(NH3)2]+ + 1 e– → Ag + 2 NH3
La semireazione di ossidazione di un’aldeide in ambiente basico è:
RCHO + 3 OH– → RCOO– + 2 H2O + 2 e–
La reazione complessiva e bilanciata sarà:
2 [Ag(NH3)2]+ + RCHO + 3 OH– → RCOO– + 2Ag + 4 NH3 + 2 H2O
Dalla soluzione incolore si ottiene un precipitato grigio di argento metallico che aderirà sulla superficie interna della provetta creando uno specchio. Tale comportamento ci confermerà la presenza di gruppi aldeidici nel campione che si sta esaminando. I chetoni non reagiscono con il reattivo di Tollens.
Libro consigliato: Link Laboratorio di chimica organica
Titolo dell’esperenza: SAGGIO DI TOLLENS
Oggetto: verifica sperimentale della presenza di gruppi aldeidici in un campione da analizzare
Materiali:
- Provette 16×160 con portaprovette;
- Piastra riscaldante; (Link Consiglio per l’acquisto);
- Becher da 500 ml con portaprovette per bagnomaria.
- Pipette Pasteur; (Link Consiglio per l’acquisto);
- Pipetta da 2 ml;
Reagenti:
- AgNO3 al 5%;
- NaOH al 5%;
- NH4OH al 2%;
- Glucosio 1% in soluzione acquosa;
- Fruttosio 1% in soluzione acquosa;
- Lattosio 1% in soluzione acquosa;
- Maltosio 1% in soluzione acquosa;
- Saccarosio 1% in soluzione acquosa;
- Acqua distillata.
Valutazione rischi:
Nonostante l’uso di reagenti diluiti, è opportuno lavorare sotto cappa aspirante e indossare i dispositivi di protezione individuale come il camice, guanti, occhialetti e mascherina. Attenzione all’argento nitrato perchè crea macchie indelebili. Si allega la scheda di sicurezza con un link sui reagenti evidenziati. Tutte le operazioni dovranno essere eseguite in presenza di un docente di chimica.
Procedimento:
- Prendere 6 provette 16×160, numerarle e porle sotto cappa aspirante;
- Versare in ognuna 20 gocce di AgNO3 al 5%;
- Aggiungere a tutte le provette 5 gocce di NaOH al 5%;
- Si formerà un precipitato di Ag2O, mescolare bene:
- Versare in ogni provetta 2 ml di NH4OH al 2%;
- Mescolare fino a completa solubilizzazione, aggiungere qualche altra goccia di NH4OH al 2% fino a che non si solubizza completamente l’Ag2O;
- Nella provetta siglata con n.1 aggiungere 1 ml di acqua distillata;
- Nella provetta n.2 versare 1 ml di glucosio all’1%;
- Nella provetta n.3 versare 1 ml di fruttosio all’1%;
- Nella provetta n.4 versare 1 ml di lattosio all’1%;
- Nella provetta n.5 versare 1 ml di maltosio all’1%;
- Nella provetta n.6 versare 1 ml di saccarosio all’1%;
- Agitare per bene e scaldare a bagno maria in un becher con acqua su piastra riscaldante;
- Attendere fino alla comparsa di uno specchio di argento sul fondo delle provette.
Nella provetta n.1 la reazione sarà sicuramente negativa perchè è presente acqua distillata non ha gruppi aldeidici; nel caso sia positiva ripreparare il reattivo di Tollens e controllare che siano perfettamente puliti i materiali in uso.
Nelle provette n.2, n.3, n.4 e n.5 la reazione si evidenzierà con la formazione di uno specchio di argento confermando la presenza nel campione di gruppi aldeidici.
Nella provetta n.6 non si osserverà alcuna trasformazione chimica essendo presente il saccarosio che è uno zucchero non riducente.
Interpretazione dei risultati e approfondimenti:
Di seguito l’estratto dall’articolo “Ricerca degli zuccheri riducenti con il reattivo di Fehling “, in cui vi è una spiegazione teorica sul comportamento degli zuccheri riducenti e non riducenti in presenza di reattivi ossidanti.
Gli zuccheri possono essere classificati in riducenti e non riducenti secondo la loro capacità di ridurre particolari reattivi in ambiente basico. Il gruppo aldeidico di uno zucchero riducente viene ossidato e si forma un acido carbossilico. Affinché uno zucchero possieda attività riducente è necessario che possa esistere in una forma a catena aperta con un gruppo aldeidico o chetonico. I monosaccaridi che contengono un gruppo aldeidico sono noti come aldosi, e quelli con un gruppo chetonico sono noti come chetosi. Gli aldosi e i chetosi vengono ossidati anche se sono impegnati nel legame semiacetalico, (che si verifica durante il processo di ciclizzazione della molecola), dato che questo viene idrolizzato velocemente in ambiente basico. Gli zuccheri impegnati in legami acetalici invece, non reagiscono perché gli acetali sono stabili alle basi e non liberano l’aldeide o il chetone, sono quindi detti zuccheri non riducenti. Nella figura seguente il glucosio è ossidato ad acido gluconico.
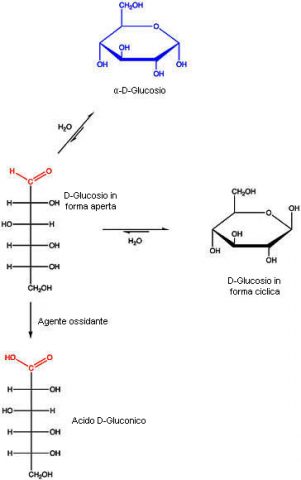
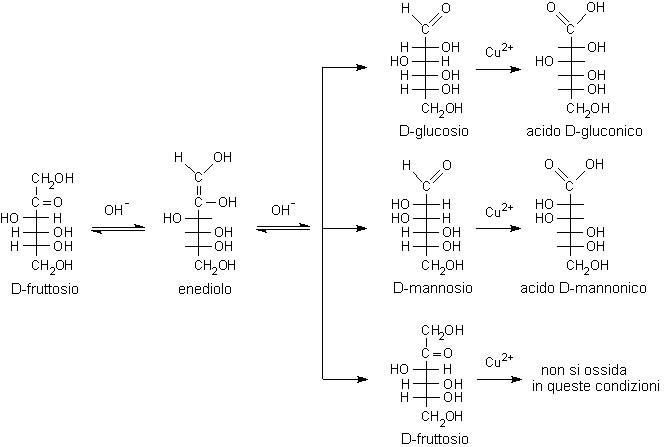
L’ossidazione avviene in ambiente basico e possono reagire anche molecole che non contengono inizialmente il gruppo aldeidico, ma che lo possono generare per isomerizzazione alcalina. È per questo motivo che danno reazione positiva non solo le aldeidi come il D-glucosio, ma anche gli α-idrossichetoni come il fruttosio che viene prima isomerizzato a glucosio e mannosio e poi, in questa forma, può essere ossidato ad acido gluconico e mannonico.
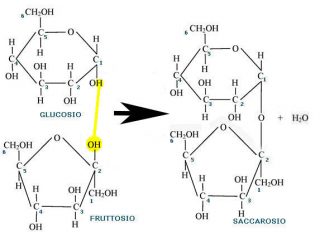
Nel caso dei disaccaridi, costituiti dall’unione di due zuccheri semplici (monosaccaridi), il legame glicosidico può interessare il carbonio anomerico di un monosaccaride e un gruppo alcolico dell’altro (come nel caso del lattosio e maltosio) o entrambi gli ossidrili anomerici, ossia quelli legati direttamente all’atomo di carbonio C1 negli aldosi e C2 nei chetosi (come nel caso del saccarosio).
Il saccarosio, infatti, è costituito dall’unione di una molecola di glucosio con una di fruttosio e il legame è di tipo 1-2 α, ß diglicosidico che interessa entrambi gli OH dei carboni anomerici. Non avendo quindi gruppi anomerici liberi, ovvero capaci di trasformarsi in gruppi carbonilici, il saccarosio è uno zucchero non riducente.
Differente è invece il caso del lattosio in cui i due monomeri, il D-glucosio e il D-galattosio, sono uniti da un legame di tipo ß 1-4, dando origine ad uno zucchero riducente in quanto è disponibile il C1 anomerico del glucosio che lo compone, per una eventuale trasformazione in gruppo aldeidico.
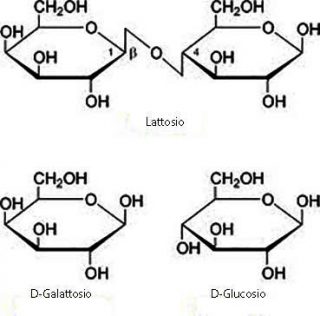
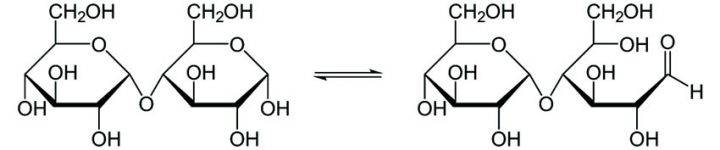
Anche nel maltosio (zucchero riducente), costituito dall’unione di due molecole di glucosio, il legame glicosidico impegna un ossidrile anomerico (C1) di un glucosio con il C4 dell’altro.
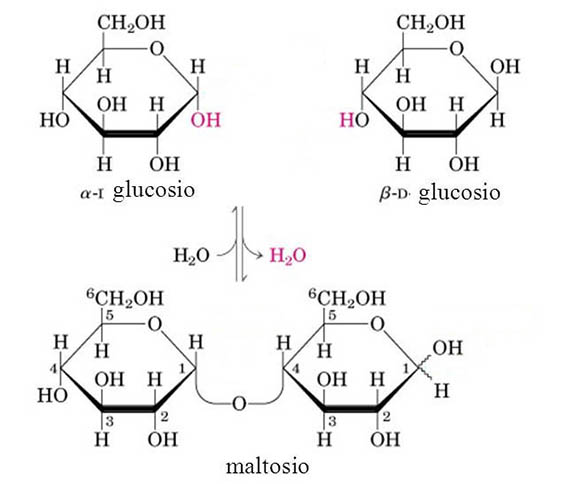
La motivazione riguardo il comportamento riducente del Maltosio e del Lattosio sta nel fatto che, in entrambi i casi, uno dei due monosaccaridi della molecola disaccaride può aprirsi per formare una catena aperta che in soluzione è in equilibrio con la forma chiusa. La catena aperta del monosaccaride coinvolto esporrà il gruppo aldeidico responsabile dell’azione riducente nei confronti dello ione diamminoargento presente nel reattivo di Tollens. Sotto è riportato l’equilibrio tra la forma ciclica e la forma a catena aperta del maltosio in cui viene a formarsi il gruppo aldeidico disponibile per una eventuale ossidazione.